Exercícios sobre Pilha Seca de Leclanché
As pilhas comuns de lanternas, brinquedos, entre outros, são chamadas de Leclanché ou pilhas secas. Em relação a essas pilhas, identifique a alternativa incorreta:
- A substância despolarizante, isto é, que evita a polarização, é o dióxido de manganês.
- O polo negativo (ânodo) dessa pilha é um envoltório de zinco.
- O bastão de grafite instalado no centro dessa pilha funciona como polo positivo (cátodo).
- Ela é uma pilha recarregável.
- Essas pilhas são chamadas também de pilhas ácidas porque contêm cloreto de amônio e cloreto de zinco, que são sais de caráter ácido.
Alternativa “d”.
Uma vez esgotadas, as pilhas secas não podem ser recarregadas para novo uso, ao contrário das baterias de chumbo.
Quando uma pilha seca comum para de funcionar, algumas pessoas colocam-na na geladeira e observam que após certo tempo ela volta a funcionar. Isso acontece porque:
- A baixa temperatura ajuda a recarregar essas pilhas.
- A baixa temperatura faz com que o gás amônia descubra o eletrodo de grafite.
- A baixa temperatura favorece a produção de MnO2, que atua como despolarizante.
- A baixa temperatura favorece a perda de elétrons do ânodo.
- A baixa temperatura favorece as reações reversíveis que ocorrem no cátodo e no ânodo.
Alternativa “b”.
No cátodo dessa pilha ocorre a seguinte reação:
Cátodo: 2 MnO2(aq) + 2 NH4 1+ (aq) + 2e- → 1 Mn2O3 (s) + 2 NH3(g) + 1 H2O(l)
A amônia (NH3(g)) formada no cátodo pode se depositar sobre a barra de grafita, dificultando a passagem dos elétrons e diminuindo a voltagem da pilha. Para voltar ao funcionamento normal, basta deixar a pilha em repouso fora do aparelho, pois o cátion zinco (Zn2+ (aq)) formado no ânodo reage com a amônia, deixando a barra de grafita livre.
Além disso, colocar a pilha na geladeira também pode ajudar, pois a diminuição da temperatura favorece a solubilidade da amônia na pasta úmida da pilha.
(PUCCamp - SP) Nas pilhas secas, geralmente utilizadas em lanternas, há um envoltório de zinco metálico e um bastão central de grafite rodeado de dióxido de manganês e pasta úmida de cloreto de amônio e de zinco, conforme a figura a seguir.

As reações são complexas, porém, quando o fluxo de corrente é pequeno, as reações podem ser apresentadas por:
Ânodo: 1 Zn → 2 e- + 1 Zn2+
Cátodo: 2 MnO2+ 2 NH41+ + 2e- → Mn2O3(s) + 2 NH3 + H2O
À medida que a pilha seca vai sendo gasta, há aumento nas massas de:
a) zinco metálico e água.
b) dióxido de manganês.
c) sais de amônio e de zinco.
d) zinco metálico e dióxido de manganês.
e) amônia, água, sais de zinco e óxido de manganês III.
Alternativa “e”.
Conforme mostram as reações, à medida que a pilha funciona, formam-se como produtos no cátodo: Mn2O3(s), NH3 e H2O; e no ânodo: Zn2+ (que constitui os sais de zinco).
(UnB-DF) As pilhas vendidas no comércio para uso em lanternas, rádios e outros aparelhos elétricos constituem-se fundamentalmente de uma cápsula de zinco, uma solução aquosa de eletrólitos (ZnCl2 + NH4Cl), dióxido de manganês e um bastão de grafita.
A figura a seguir representa um corte longitudinal de uma pilha de manganês.
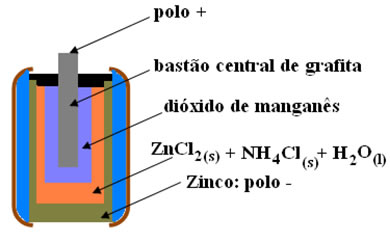
Durante o funcionamento da pilha, ocorrem as seguintes reações:
No ânodo: Zn(s) → Zn2+(aq) + 2 e-
No cátodo: 2 MnO2(s) + 2 NH41+(aq) + 2e- → Mn2O3(s) + 2 NH3(aq) + H2O(ℓ)
Julgue os itens a seguir:
- Mn4+ é o agente redutor.
- Durante o funcionamento dessa pilha, o fluxo de elétrons ocorre no sentido grafita → zinco.
- A reação global da pilha é:
Zn(s) + Mn2O3(s) + 2 NH3(aq) + H2O(ℓ) → Zn2+(aq) + 2 MnO2(s) + 2 NH41+(aq) + 4e-
- A quantidade de Zn2+ diminui durante o funcionamento da pilha.
- A pilha cessará seu funcionamento quando o MnO2 for totalmente consumido.
Apenas o item 4 está correto.
- Errado. O agente redutor é o Zn0.
Fazendo a somatória dos dois eletrodos, temos a reação global:
Zn0(s) ↔ Zn2+(aq) + 2 e-
2 MnO2(s) + 2 NH41+(aq) + 2e- ↔ Mn2O3(s) + 2 NH3(aq) + H2O(ℓ)
Zn0(s) + 2 MnO2(s) + 2 NH41+(aq) ↔ Zn2+(aq) + Mn2O3(s) + 2 NH3(aq) + H2O(ℓ)
Zn0(s) → oxidação → Zn2+(aq)
Mn4+ (MnO2(s)) → redução → Mn3+( Mn2O3(s))
Zn0(s) → agente redutor
MnO2(s)→ agente oxidante
- Errado. O fluxo de elétrons ocorre no sentido do zinco para a grafita.
- Errado. A reação total da pilha é a resolução da somatória dos dois eletrodos acima.
- Errado. A quantidade de Zn2+ aumentará em virtude da perda de elétrons durante o funcionamento da pilha.






